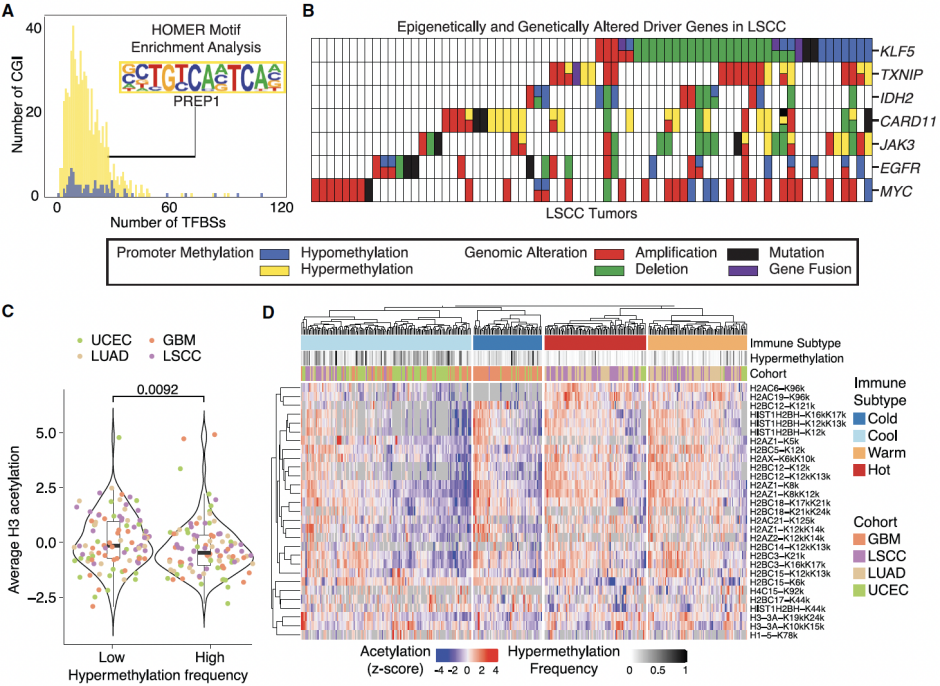
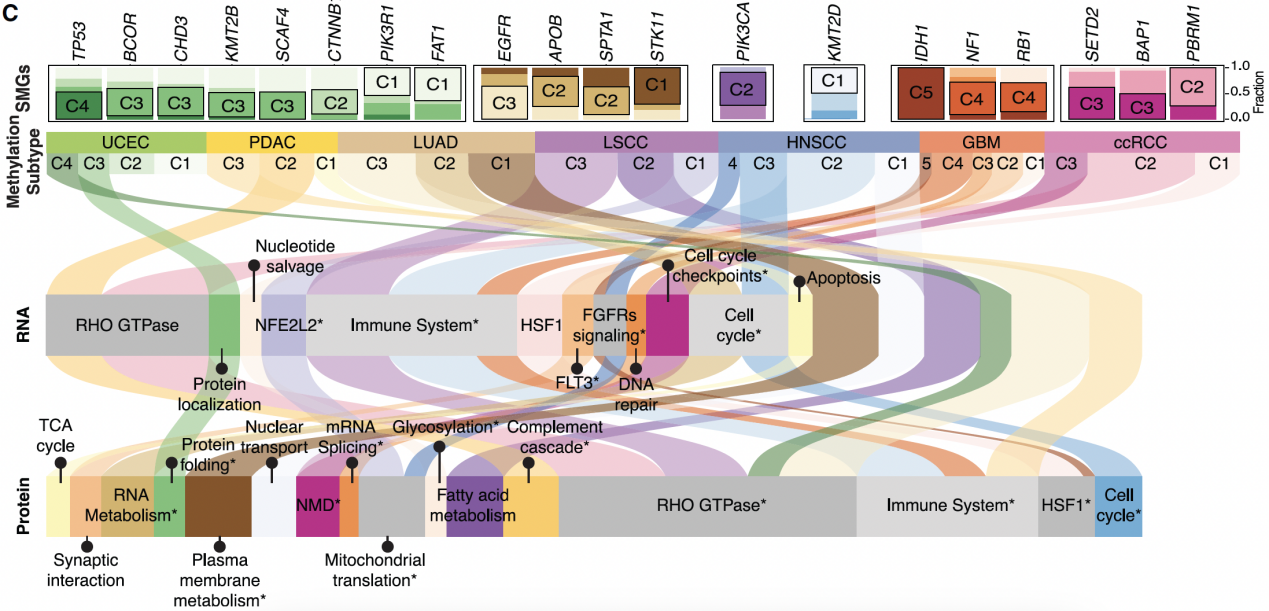
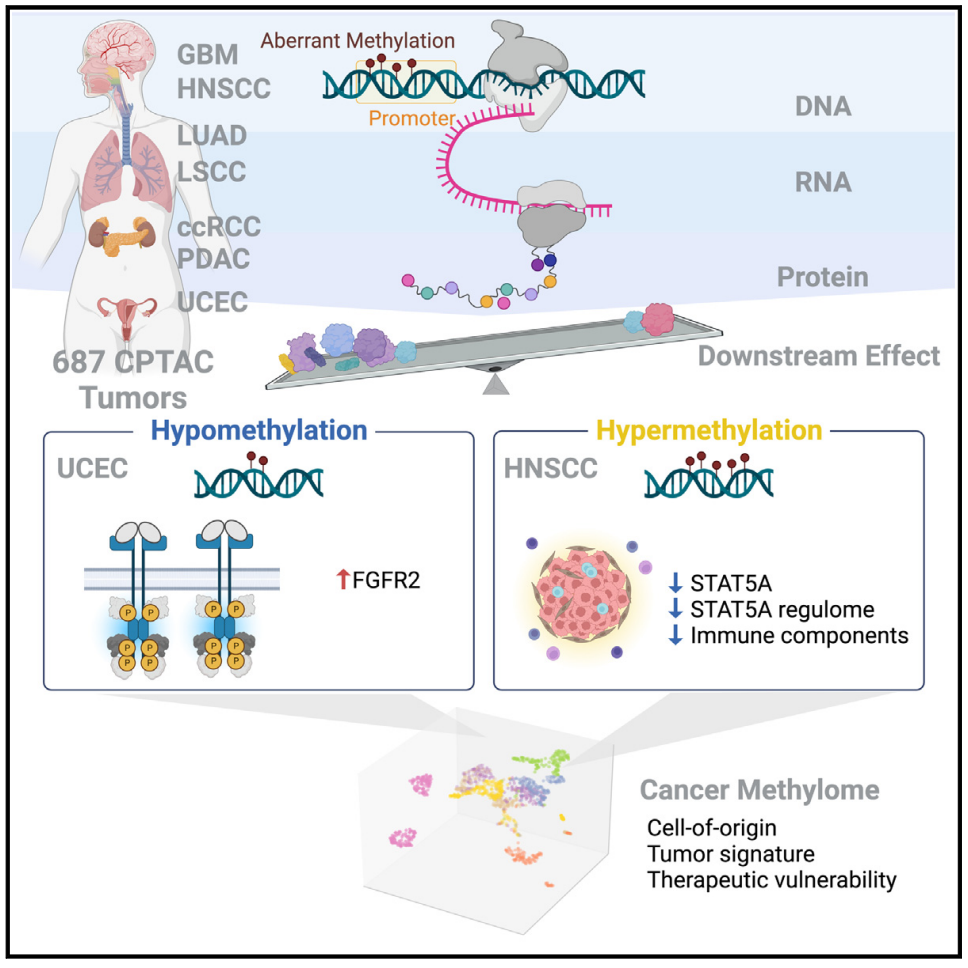
异常DNA甲基化是人类肿瘤发生和发展的一个标志。在整体低甲基化的重复序列上和基因特异性高甲基化的CpG岛上,都可以观察到异常的DNA甲基化。启动子异常DNA甲基化可以沉默肿瘤抑制基因的表达或解除原癌基因的限制。DNA甲基化的广泛变化通常出现在肿瘤发生的早期阶段,这表明异常DNA甲基化的驱动作用。识别异常DNA甲基化的功能后果对于改善肿瘤诊断、预后和治疗至关重要。然而,识别在肿瘤中具有功能的DNA甲基化模式并将其与组织特异性表观遗传特征区分开来仍然具有挑战性。虽然一些分析方法有助于探索DNA甲基化和基因表达变化之间的联系,但大多数研究仅关注转录组的表达。2023年8月14日,来自美国圣路易斯华盛顿大学的Li Ding研究团队和临床蛋白质组肿瘤分析联盟(Clinical Proteomic Tumor Analysis Consortium)在Cancer Cell杂志上发表题为Integrative multi-omic cancer profiling reveals DNA methylation patterns associated with therapeutic vulnerability and cell-of-origin的研究论文,对687个肿瘤组织及匹配的癌旁组织进行了多组学分析,识别了与RNA和蛋白质丰度变化相关的异常DNA甲基化,揭示了共有的和组织特异性的表观遗传事件,并构建了泛肿瘤图谱。研究者通过对7种肿瘤(共计687个肿瘤组织)的甲基化图谱、基因表达和蛋白质丰度数据进行分析,发现RNA表达与蛋白质丰度正相关,启动子DNA甲基化与RNA表达或蛋白质丰度负相关——这与以往的报道一致。然而,当只关注mRNA与蛋白质具有高相关性的10844个基因时,研究者发现18.4%基因的启动子甲基化仅与RNA表达相关,3.5%基因仅与蛋白质丰度相关,而只有13.9%基因与RNA表达、蛋白质丰度均相关。甲基化对蛋白质组的有限影响可能和翻译调控、组织特异性表达、蛋白质降解和翻译后修饰等因素有关,这强调了DNA甲基化对基因调控影响的复杂性和特定性。研究者在7种肿瘤中分别比较了肿瘤和癌旁组织,从而分析不同肿瘤之间共同和组织特异的DNA甲基化模式。结果观察到41个异常甲基化事件是肿瘤类型特异,只有5个异常甲基化事件在不同肿瘤间是常见的,即低甲基化EGFR和高甲基化STAT5A、MGMT、CARD11和TRIM22。这些异常DNA甲基化模式的普遍性和特异性表明它们在肿瘤发展中的重要作用。由于DNA甲基化会影响转录因子的结合,研究者对299个肿瘤驱动基因的顺式作用(Cis-acting)异常DNA甲基化进行了表征,这些基因至少与1个转录因子结合位点(TFBS)相关,通过基序富集分析,研究者发现超甲基化位点中最富集的TFBS之一是PREP1——作为肿瘤抑制因子维持着基因组稳定性(如图1A所示)。这表明,转录因子可能既是肿瘤中异常DNA甲基化的读取器又是效应器,导致产生异常的mRNA和蛋白质。研究者发现对于具有顺式作用DNA甲基化的驱动基因,大多数甲基化事件与基因组改变是相互排斥的(如图1B所示),同时还发现高频率超甲基化的肿瘤与组蛋白H3乙酰化水平降低显著相关(如图1C所示),这表明超甲基化的基因表达抑制作用。此外,免疫冷组(Immune-cool)的肿瘤与超甲基化频率存在关联(如图1D所示)。DNA甲基化和组蛋白乙酰化之间的互斥模式和相互作用表明,DNA甲基化有助于肿瘤正向选择和组蛋白变化,可能在肿瘤发生中发挥驱动作用。图1. 顺式作用异常DNA甲基化可能驱动肿瘤发生发展研究者发现,包括FGFR2和EGFR在内的几种受体酪氨酸激酶(Receptor tyrosine kinase,RTK)在子宫内膜癌(Uterine corpus endometrial carcinoma,UCEC)和其他肿瘤中处于低甲基化状态。通过数据分析,研究者发现低甲基化FGFR2的UCSC肿瘤中同时伴随着基因组突变。为了区分FGFR2低甲基化与同时发生的突变的致癌作用,研究者根据FGFR2基因组改变的类型对UCEC肿瘤进行分类并观察FGFR2的表达,结果发现不论基因组如何突变,FGFR2低甲基化肿瘤中RNA表达或蛋白质丰度始终高于FGFR2甲基化正常的肿瘤。尽管人们早已知道RTK中反复出现的功能获得性基因组改变会促进肿瘤发生,但该研究结果表明,RTK低甲基化也是多种肿瘤发生发展的表观遗传驱动因素。转录因子表达的改变可以破坏其调节子(调节子是一组受共同调节元件调节的基因)的活性,为了评估异常DNA甲基化对调节子活性的影响,研究者首先在转录因子上鉴定了14个顺式作用高甲基化事件,结果发现高甲基化转录因子与低调节子活性之间存在显著关联。这些转录因子中包括了STAT5A,他们发现高甲基化的STAT5A与细胞因子产生、细胞毒性、细胞增殖和干扰素信号传导的调节有关。最近有研究表明,STAT5A介导的干扰素信号传导调节CD274(编码PD-L1)和PDCD1LG2(编码PD-L2)的表达,这反映了STAT5A信号在免疫治疗中的临床意义。为了了解高甲基化STAT5A是如何影响肿瘤微环境的,研究者使用xCell从大量细胞转录组数据中解析了头颈鳞状细胞癌(Head and neck squamous cell carcinoma,HNSCC)和肺鳞状细胞癌(Lung squamous cell carcinoma,LSCC)的免疫细胞组成。他们发现,STAT5A高甲基化样本在HNSCC和LSCC的免疫冷组中显著富集,而且STAT5A高甲基化样品中免疫效应子和树突状细胞相关的基因表达显著降低,这些结果表明,STAT5A高甲基化与鳞状肿瘤中免疫细胞耗竭相关。此外,通过免疫组化标记,研究者发现STAT5A在肿瘤浸润淋巴细胞(Tumor-infiltrating lymphocyte,TIL)和瘤周淋巴细胞中表达,但是在肿瘤细胞中表达极少或不表达,并且STAT5A丰度的总体水平与TIL或瘤周淋巴细胞的水平相关。有趣的是,在高甲基化STAT5A样本中,肿瘤细胞和表达STAT5A的免疫细胞之间存在明显的边界,而在正常甲基化STAT5A肿瘤样本中,肿瘤细胞和表达STAT5A的免疫细胞是混合在一起的。因此研究者推测,具有高甲基化STAT5A的免疫细胞可能会限制淋巴细胞在肿瘤微环境中的迁移。这些发现表明,STAT5A高甲基化可能介导STAT5A靶向基因的疾病依赖性表达,并导致肿瘤免疫原性改变。通过对肿瘤和癌旁组织的CpG岛甲基化信号的聚类分析,研究者发现样品之间最明显的差异是组织类型的差异,其次才是肿瘤和癌旁的差异,这表明肿瘤的DNA甲基化模式可以有效地反映肿瘤的细胞起源和恶性转化情况。而且他们还发现,基于DNA甲基化对肿瘤样本进行聚类可以帮助识别分子和临床相关的肿瘤亚型。此外,通过差异表达基因和蛋白质的分析,他们还发现了与肿瘤发生相关的信号通路(如图2所示)。通过将顺式作用DNA甲基化与肿瘤变异的临床解释(Clinical Interpretation of Variants in Cancer)相结合,研究者分析了具有异常表达的靶基因——这些基因可能可以进行药物干预。7种肿瘤中可药物干预DNA甲基化事件的最常见相关基因是:MGMT(45个肿瘤)、NAPRT(31个肿瘤)和EGFR(26个肿瘤)。因此,肿瘤中顺式作用异常DNA甲基化的这些特征揭示了治疗优化的潜在新方向。总体而言,该研究使用多组学的方法,分析确定了驱动转录和翻译变化的顺式作用DNA甲基化事件,揭示了肿瘤的表观遗传特征及其起源细胞的作用。https://doi.org/10.1016/j.ccell.2023.07.013